 |
国家兽药产业技术创新联盟 National veterinary drug industry technology innovation alliance |
用户登录
联系我们
|

为此,联盟微信公众号设立《新技术&研究进展》栏目,收集、发布兽药产业相关技术创新及研究进展,本期介绍贵州大学汤德元教授团队发表的《猪瘟病毒新型检测技术的研究进展》(本文刊发于黑龙江畜牧兽医2022年第12期)。
猪瘟病毒(Classical swine fever virus,CSFV)是一种能引起猪只急性、热性和全身性败血性疾病的RNA病毒,妊娠母猪、种用公猪感染后分别表现为繁殖障碍和精液带毒,仔猪感染后出现神经症状。我国是生猪养殖和消费大国,生猪养殖量和存栏量均占全球总量一半以上,加上生猪养殖规模化程度低,生猪调运频次高、数量多,一旦爆发猪瘟会给我国生猪养殖业带来重大经济损失。笔者总结了近年来CSFV的检测技术,传统检测技术包括酶联免疫吸附试验(enzyme linked immunosorben assay,ELISA)、聚合酶链式反应(polymerase chain reaction,PCR),新型检测技术包括免疫层析试纸条、免疫色谱横向流动检测(immuno-chromatographic lateral flow assay,LFA)、抗原捕获酶免疫分析(anti-gen-capture enzyme immunoassy,EIA)、化学发光免疫分析(chemiluminescence immunoassays,CLIA)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)、重组酶介导扩增(recombinase-aidamplifacation,RAA)、微滴式数字PCR(microdroplet digital PCR,ddPCR)及其他新型检测技术等,分析上述检测方法的优缺点,以期为临床上检测猪瘟病毒提供可靠有效的方法指导。
基金项目:贵州省科技支撑计划项目(黔科合支撑〔2021〕一般162)
作者简介:陈旭,女(土家族) ,硕士研究生,研 究方向为动物传染病病原分子生物学,2428367165@qq.com
通信作者:汤德元 ,男,教授,博士,博士生导 师,研究方向为动物传染病病原分子生物学和中西兽医结合,tdyuan@ 163.com
猪瘟病毒(Classical swine fever virus,CSFV)属于黄病毒科中的一种具有囊膜结构的单股正链RNA病毒,能引起猪只发生急性、热性和全身败血性疾病。CSFV野毒株的毒力差异很大,强毒株可引起猪只发生典型的猪瘟症状,通常表现为高热、极度嗜睡、体内器官呈败血性变化,致死率高,临床上比较少见;中等毒力的毒株可引起猪只高热、轻度嗜睡、淋巴器官内轻度出血,但致死率低。妊娠母猪感染CSFV后可经胎盘垂直传递给胎儿,产生弱仔猪、死胎、木乃伊胎;种用公猪感染CSFV后引起精液带毒;初生仔猪感染CSFV后出现神经症状,表现为持续性感染并终身带毒,出现免疫耐受。近年来,CSFV给世界各地养猪业带来巨大的经济损失,尽管猪瘟兔化弱毒疫苗(C株)可以有效预防猪瘟的发生,但在免疫压力和气候环境等多种因素的影响下,CSFV已经出现变异。胡玲玲等分离出CSFV GZA株,该毒株的E2基因序列与我国CSFV参考毒株序列[标准化强毒株Shimen株(GenBank登录号为AY775178)、C株(GenBank登录号为Z46258)、HCLV株(GenBank登录号为AF531443)]相比存在多个氨基酸变异位点。传统CSFV检测技术具有较高的灵敏度和特异性,但近年来出现的许多基于传统检测技术创新而来的新型CSFV检测技术,在灵敏度、操作方法、检测成本等方面都有所优化。笔者综述了传统CSFV检测技术及新型CSFV检测技术的研究进展,旨在为临床CS-FV检测提供方法参考。
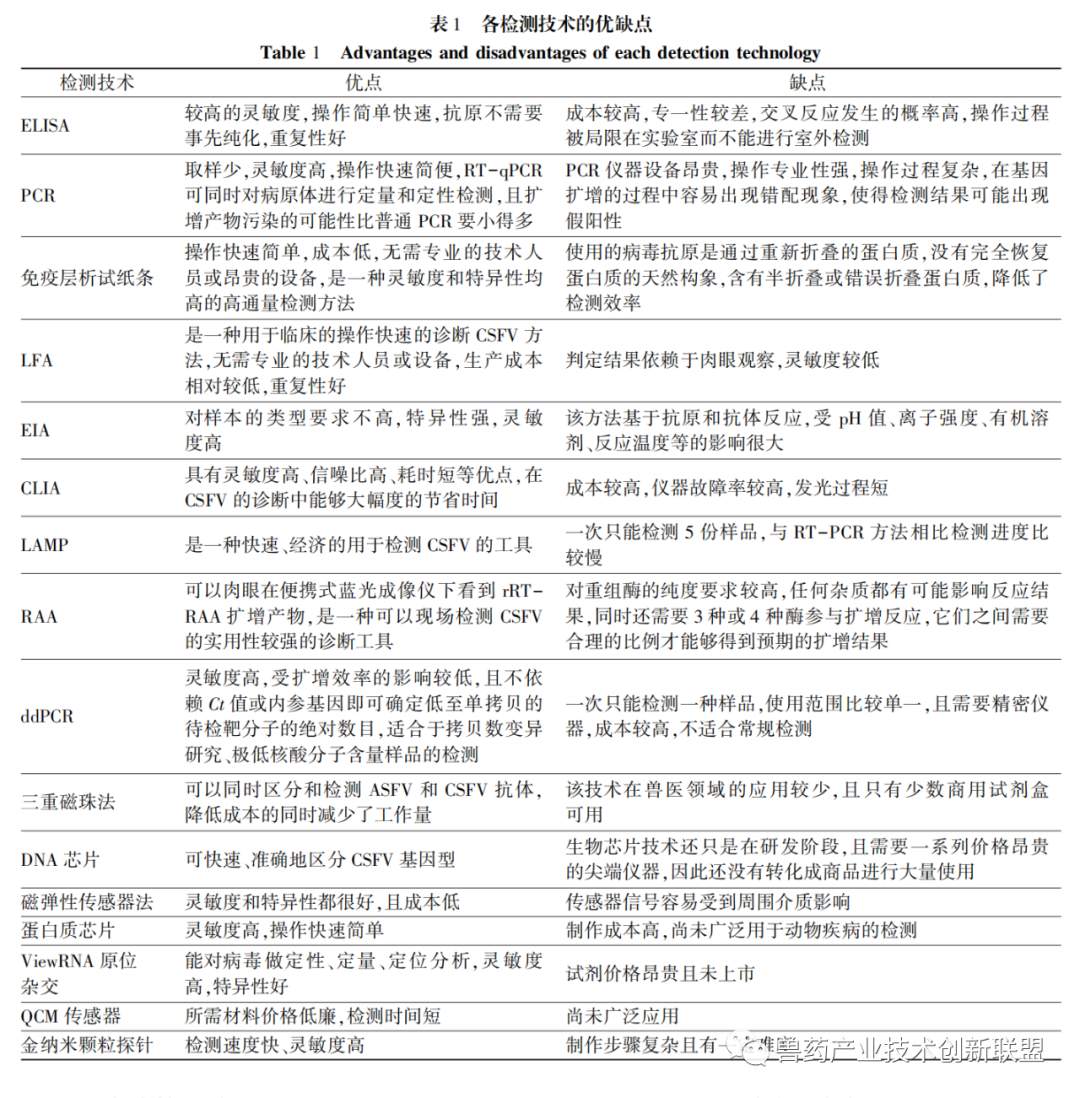
ELISA是将可溶性的抗原或抗体吸附到聚苯乙烯等固相载体上进行免疫反应的一种定性和定量方法,是临床上最受欢迎的检测CSFV方法之一。陈九等利用大肠杆菌表达CSFVE2蛋白主要抗原区,建立了CSFV间接ELISA抗体检测方法,并对556份临床疑似猪瘟样品进行检测,结果表明,与猪瘟阻断ELISA试剂盒(美国IDEXX公司生产)的阳性符合率为90.8%,阴性符合率为93.29%,总符合率为91.52%。侯玉珍等建立了针对CSFVE2重组蛋白的双抗体夹心ELISA检测方法,结果表明,CSFVE2蛋白标准品的稀释浓度在2.43~77.65μg/mL范围内有很好的线性关系,且重复性试验的变异系数小于15%,表明该方法的重复性和稳定性较好,为CSFVE2蛋白的定量检测提供了良好的方法。吴许丹等建立了检测CSFV EO抗体的ELISA方法,结果表明,该方法特异性、稳定性和灵敏性均良好。ELISA具有灵敏度高、操作简单快速、抗原不需要提前纯化、重复性好等优点,但存在成本较高、专一性较差、交叉反应发生的概率高、操作过程被局限在实验室而不能进行室外检测等缺点,见表1。
1.2 聚合酶链式反应(polymerase chain reaction,PCR)
PCR是临床上最常用的CSFV检测方法之一,具有快速、经济、特异性强等优势。目前,许多地区发生的猪瘟已不再由单一的CSFV感染所引起,而是由多种病毒混合感染所引起。史喜菊等建立了同时可检测和鉴别CSFV、非洲猪瘟病毒(African swine fever virus,ASFV)和猪水泡病毒(Swine vesicular disease virus,SVDV)的多重荧光逆转录PCR(revers transcription-polymerase chain reaction,RT-PCR)方法,结果表明:该方法最低检测量可达到1~10拷贝/μL,特异性高达100%。杨峰等建立了检测CSFV的实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)方法,结果表明该方法具有特异性强(只能检测出CSFV)、灵敏度高(最低检测量可达到24.47拷贝/μL)、重复性好等特点。PCR具有取样少、灵敏度高、操作快速简便等优点,RT-qPCR可同时对病原体进行定量和定性检测,由于采用封闭检测模式,因此扩增产物污染的可能性比普通PCR要小得多;但PCR仪器设备昂贵,操作专业性强、过程复杂,且在基因扩增过程中容易出现错配现象,使得检测结果可能出现假阳性。见表1。
2.1 免疫层析试纸条检测技术
免疫层析试纸条检测技术是基于免疫标记技术和色谱层析技术发展起来的一种可用于检测抗原、抗体或半抗原的检测技术。万颖等将胶体金颗粒标记的CSFVE2蛋白及其单克隆抗体包被于硝酸纤维素膜(nitrocellulose membrance,NC)上,分别作为检测线(T线)和质控线(C线),组装成检测CSFVE2蛋白抗体的胶体金免疫层析试纸条,该试纸条可在5~10min之间完成检测,且与其他病毒的阳性血清无交叉反应,特异性强,灵敏度高。Li X.等基于CS-FVCnC2蛋白研制了一种用于快速检测免疫猪瘟疫苗后的猪血清中CSFV抗体效价的免疫层析试纸条,即将葡萄球菌蛋白A(Staphylococcal aureus protein A,SpA)和抗CnC2单克隆抗体(anti-CnC2 monoclonal antibodies,mAbs)吸附于NC上,分别作为检测线和质控线,该试纸条可在5min内完成检测,且不需要任何特殊设备;利用该试纸条对含有不同CSFV株血清样品进行检测,发现其敏感性为97.0%,特异性为100%,与CSFV AbELISA试剂盒(购自美国IDEXX公司)检测结果一致,相关系数为0.935。Bai Y.等开发了一种基于CSFV重组E2蛋白的新型高敏免疫层析试纸条,用于CSFV抗体检测,其灵敏度是CnC2试纸条的4倍。免疫层析试纸条操作快速简单,成本低,无需专业的技术人员或昂贵的设备,是一种灵敏度和特异性均高的高通量检测方法,但是其所用的病毒抗原是通过重新折叠的蛋白质,没有完全恢复蛋白质的天然构象,含有半折叠或错误折叠蛋白质,降低了检测效率,见表1。
2.2 免疫色谱横向流动检测(immunochromatographic lateral flow assay,LFA)
R.Sambandam等开发了一种用于检测CSFV的LFA方法,最低检测限为36.8 TCID50/mL,该方法的灵敏度和特异性分别为80.36%和87.10%,用该方法检测了72份临床样品,阳性和阴性检出率分别为91.84%和87.10%。P.Sastre等为了能同时检测和区分CSFV和ASFV抗体,基于CSFVE2蛋白和ASFV VP72蛋白开发了一种LFA方法,结果表明,该方法能够检测到ASFV或CSFV抗体,显示出良好的灵敏度和特异性。CSFV-LFA是一种用于临床的操作快速的诊断CSFV的方法,无需专业的技术人员或设备,生产成本相对较低,重复性好,但是判定结果依赖于肉眼观察,灵敏度较低,见表1。
2.3 抗原捕获酶免疫分析(antigen-capture enzymeimmuno assay,EIA)
A.Clavijo等开发了一种用于检测CSFV抗原的EIA方法,该方法可直接从组织悬液中检测到CSFV抗原,特异性为98.7%,敏感性为91.4%,且操作简单,可在4h内完成检测,并可用于筛查疑似CS-FV感染的猪只组织样本。EIA对样本类型要求不高,特异性强,灵敏度高,该方法基于抗原和抗体反应,受pH值、离子强度、有机溶剂、反应温度等的影响很大,见表1。
2.4 化学发光免疫分析(chemiluminescence immunoassays,CLIA)
MaZ.等利用CSFV E2重组蛋白和过氧化酶结合MAb开发了一种竞争性化学发光免疫分析(competition-based chemiluminescence immunoassays,cCLIA)方法,用于快速、准确地检测猪血清中CSFVE2抗体,结果表明,该方法的灵敏度和特异性均高于竞争性酶联免疫吸附试验(competition-based enzyme-linked immunosorbent assay, cELISA),且可以在20min内完成检测,而cELISA至少需要1h。cCLIA方法具有灵敏度高、信噪比高、耗时短等优点,在CSFV的诊断中能够大幅度的节省时间,具有很高的应用价值,但成本较高,仪器故障率较高,发光过程短。见表1。
2.5 环介导等温扩增(loop-mediated isothermal amplification,LAMP)
LAMP是多种核酸扩增技术中的一种,即通过对靶基因的6个区域设计3对特异引物,利用链置换DNA聚合酶在恒温条件下作用30~60min内完成扩增反应。Chen L.等建立了一种简单、快速的用于检测CSFV的反转录循环介导等温扩增(reverse transcription loop-mediated isothermal amplification,RT-LAMP)方法,即通过利用一对外部引物、一对内部引物和一对循环引物在恒温条件下检测CSFV,结果表明,该方法灵敏度高于RT-PCR。
ChenH.T.等评估了RT-LAMP方法对经典CSFV感染的临床样品的检测效果,结果表明:RT-LAMP可以在65℃的恒温条件下1h内完成检测,同时对未接种猪瘟疫苗的猪的血液、扁桃体、鼻拭子等样本进行RT-LAMP、RT-PCR和病毒分离,三种检测技术的检出率分别为89%、78%和71%,表明RT-LAMP方法较其他两种方法敏感性高,但该方法一次只能检测5份样品,与RT-PCR方法相比检测进度比较慢。RT-LAMP方法是一种快速、经济、高效的用于检测CSFV工具,对经典猪瘟的快速临床前检查和监测具有潜在效用。见表1。
2.6 重组酶介导扩增(recombinase-aid amplification,RAA)
RAA是一种可以在恒温下快速扩增核苷酸的方法,通常在1h内完成检测,由于整个反应不需要高温循环,因此适合在非实验室场合且有大量需要检测的临床样品情况下使用。已有研究结果表明,RAA可用于ASFV和PCV2的快速检测。TuF.等开发了一种基于荧光探针的用于检测CSFV的实时逆转录重组酶辅助扩增(real-time reverse transcription recombinase-aid amplification,rRT-RAA)检测方法,靶向所有CSFV基因型中5′非翻译区域(5′non-translated region,5′NTR)内的高度保守位置,结果表明,该方法具有良好的重复性、特异性和灵敏性,并且可以肉眼在便携式蓝光成像仪下看到rRT-RAA扩增产物,是一种可以现场检测CSFV的实用性较强的诊断工具。薛俊欣等建立了基于RAA-Cas13a的CSFV检测方法,对不同浓度的阳性质粒、阳性样品和7种其他猪病病毒样品进行RAA扩增,扩增产物中加入Cas13a酶切体系,然后收集荧光,结果表明,Cas13a酶切体系可以放大普通RAA检测信号,从而提高RAA反应的灵敏度,该方法特异性良好,检测变异系数小于5%,可进行现场测试,具有推广应用的潜力,对重组酶的纯度要求较高,任何杂质都有可能影响反应结果,同时还需要3种或4种酶参与扩增反应,它们之间需要合理的比例,才能够得到预期的扩增结果。见表1。
2.7 微滴式数字PCR(microdropled digital PCR,ddPCR)
ddPCR是在传统PCR基础上对扩增前样品进行稀释处理,即将样品分为若干微滴小份,每小份可能含有或不含有待检核酸,经扩增后,对每小份进行检测,通过荧光信号结合泊松分布原理来判断核酸的含量。近年来,ddPCR广泛应用于临床病原微生物检测、肿瘤相关基因检测中。高晓龙等建立了用于检测CSFV的ddPCR方法,该方法最低检测限为3.2拷贝/μL,灵敏度高,在读取结果时仅判断阳性或阴性,受扩增效率的影响较低,且不依赖Ct值或内参基因即可确定低至单拷贝的待检靶分子的绝对数目,适合于拷贝数变异研究、极低核酸分子含量样品的检测,但是该方法一次只能检测一种样品,使用范围比较单一,且需要精密仪器,成本较高,不适合常规检测。见表1。
2.8 其他新型检测技术
C.Aira等开发了一种基于三重磁珠的检测方法,即采用ASFV的VP72和VP30蛋白和CSFV的E2蛋白这些最具免疫原性的抗原来同时检测两种病毒抗体,其中对CSFV抗体的检测灵敏度为95.7%,特异性为99.8%。这种多重检测方法可以同时区分和检测ASFV和CSFV抗体,降低成本的同时减少了工作量,为病毒检测提供了有价值的工具,然而该技术在兽医领域的应用较少,且只有少数商用试剂盒可用。见表1。
Y.K.Kim等建立了用以快速区分3个基因型的CSFVDNA芯片检测方法,即从临床样本中提取CSFVRNA进行反转录后扩增,将扩增产物与CSFVDNA芯片杂交,然后进行荧光扫描检测CSFV。该方法可快速、准确地区分CSFV基因型,有助于CSFV根除策略的实施,但该方法还处于研发阶段,且需要一系列价格昂贵的仪器,还没有形成产品进行大量使用。见表1。
WuY.等开发了一种以猪细小病毒(Porcine parvovirus,PPV)、日本脑炎病毒(Japanese encephalitis virus,JEV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、CSFV4种病毒蛋白为捕获抗原的新型荧光蛋白质芯片检测方法,结果表明,阳性样品的检出率在95%以上且无交叉反应。这种蛋白质生物芯片方法具有操作快速、简单、灵敏度高的优点,但因为其制备成本很高,尚未广泛用于动物疾病的检测。见表1。
Guo X.等设计了检测CSFV的磁弹性传感器检测系统,结果表明,该系统的灵敏度约为95Hz/(μg·mL),检测限为0.6μg/mL,虽然传感器信号容易受到周围介质影响,但灵敏度和特异性都很好,且成本低,在未来CSFV检测中有良好的应用前景。见表1。Zhang Q.等首次提出了ViewRNA原位杂交(insituhybridization,ISH)方法,以揭示CSFVRNA在PK15细胞中的动态分布。ViewRNAISH的灵敏度比荧光抗体测试(fluorescent antibody test,FAT)和免疫组织化学(immunohistochemical,IHC)方法高,且对CSFV有很强的特异性,与其他猪相关病毒没有交叉反应。ViewRNAISH能对病毒做定性、定量、定位分析,灵敏度高,特异性好,但因试剂价格昂贵而未上市。见表1。
S.Klangprapan等设计了一种以分子印迹聚合物(molecularly imprinted polymer,MIP)为受体的石英晶体微量天平(quartz crystal microbalance,QCM)传感器,用于检测CSFV。MIP价格低廉,并产生与天然受体相当的高亲和力和选择性,因此该检测传感器可以在短时间内检测到CSFV,为CSFV的快速检测开辟了一条新的道路,但尚未广泛应用。见表1。
NingP.等设计了一种检测CSFV的金纳米颗粒探针,原理是金纳米颗粒(gold nanoparticles,AuNPs)可以与CSFVRNA互补的DNA结合,进而产生荧光信号来证明病毒的存在。该方法检测速度快、灵敏度高,而无需病毒核酸扩增,可应用于动物疫病防控,但该探针的制作步骤复杂且有一定难度,不适用于CSFV的一般检测。见表1。
猪瘟是一种具有高度传染性的疾病,属于一类动物疫病。近年来由于CSFV相关疫苗大量使用,使得大规模的猪瘟疫病爆发概率明显降低,但是一旦出现强变异毒株,现有疫苗将不会发挥很好的作用,所以做好养猪场防疫净化至关重要。目前传统ELISA和PCR方法因具有良好的灵敏性和特异性、高效且检测快速的优点而得到广泛应用。近几年新型检测技术层出不穷,每种技术都有各自的优缺点,如需进行现场检测可采取RT-RAA或LFA;如果考虑检测成本,可用免疫层析试纸条、LAMP或LFA进行检测;如果一次需检测大量样品,则不能用LAMP和ddPCR进行检测。因此在进行CSFV检测时应该结合自身设备条件及检测的样本量而选择最适合的检测方法。
参考文献:略
编辑:周盼伊
审核:刘业兵
免责声明
本栏目旨在信息共享交流,此文版权归原作者及期刊所有,若有来源错误或者侵犯您的合法权益,请及时联系我们,13522200413(微信同号)。
国家兽药产业技术创新联盟 National veterinary drug industry technology innovation alliance |
扫一扫  |
| 联系电话:010-62103991转611 联系地址:北京市海淀区中关村南大街8号 备案:京ICP备20024024号 |